L'unité de recherche "Biologie moléculaire et immunologie parasitaires" (Bipar - Anses-EnvA-Inrae) reçoit une subvention de l'Agence nationale de la recherche. Plus de 400 000 euros dédiés au projet "AxoTick" pour étudier l'interaction du système nerveux central des tiques (synganglion) avec leurs glandes salivaires. Objectif : comprendre ce parasite pour mieux lutter.

Un projet de recherche sur les tiques porté par Ladislav Simo, chercheur au sein de l'unité mixte de recherche "Biologie moléculaire et immunologie parasitaires" (Bipar - Anses-EnvA-Inrae), groupe NeuroPaTick, bénéficie d'un soutien de l'Agence nationale de la recherche (ANR) à hauteur de 400 000 euros. Ce projet "AxoTick" doit étudier l'interaction du système nerveux central des tiques (synganglion) avec leurs glandes salivaires. Il permettra de mieux comprendre le fonctionnement de ces parasites, Ixodes ricinus, la tique européenne du ricin, étant l’un des vecteurs importants dans la transmission des agents viraux, bactériens et protozoaires impliqués dans les maladies à tique.
Comprendre le rôle des glandes salivaires
Dans cette transmission d'agents infectieux, le rôle crucial des glandes salivaires a été mis en évidence. Les glandes salivaires des tiques ressemblent à des grappes de raisins. Et les petits raisins sont appelés acini.
Dans la glande salivaire femelle des tiques, il existe trois types d'acini (I, II et III).
- Les types II et III produisent de la salive qui est sécrétée dans les conduits sur lesquels les acini sont assis. Environ 1000 acini produisant de la salive sont contrôlés par deux cellules neuronales (des neurones). Ces deux cellules produisent de petites protéines (appelées neuropeptides) - on dit qu'elles sont neuropeptidergiques. Ces neuropeptides sont délivrés par les corps cellulaires neuronaux (dans le synganglion) aux glandes salivaires via leurs projections axonales. L'axone sert de tube et les neuropeptides voyagent de ces neurones aux acini des glandes à l'intérieur de ces tubes (axones). Dans les acini des glandes salivaires, ces petits neuropeptides sont libérés à l'extrémité de ces axones (appelés terminaisons axonales). Ces peptides contrôlent probablement les activités sécrétoires des acini.
- Quatre autres neurones (également neuropeptidergiques) contrôlent exclusivement les acini de type II.
Il semble donc que deux axones neuropeptidergiques différents contrôlent tous les acini de type II et III (deux neurones) ou de type II (quatre neurones) pour leurs activités. Le signal (neuropeptides délivrés aux glandes salivaires) va donc du synganglion aux glandes.
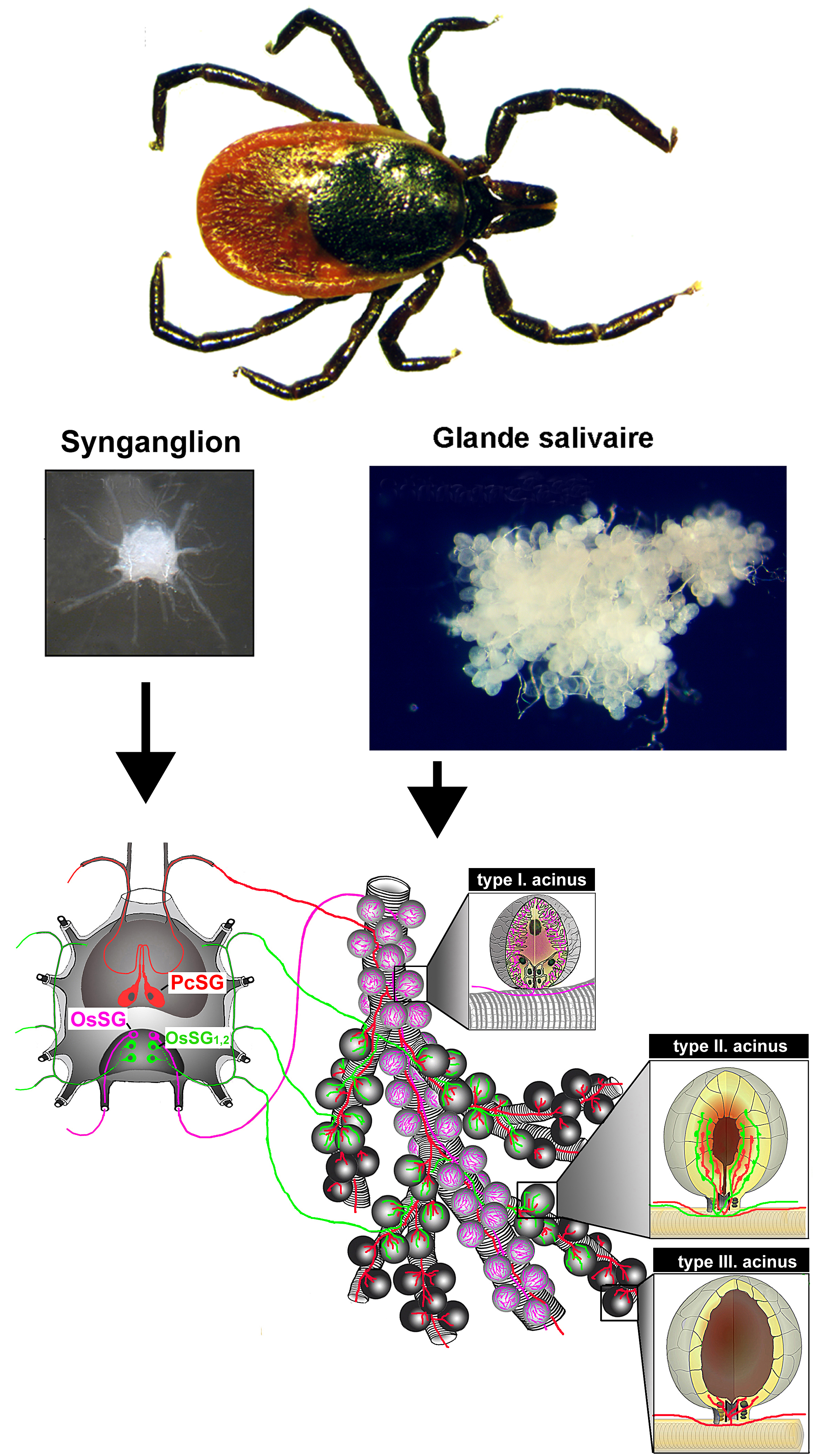
Les neurones producteurs de neuropeptides (cellules 2 et 4) délivrent donc les neuropeptides aux acini via des projections axonales. Cependant, dans la glande salivaire, de l'acétylcholine est synthétisée dans les acini et active des protéines, les récepteurs cholinergiques (aux extrémités des axones neuropeptidergiques dans les acini). Ce signal va de la glande salivaire aux cellules neuronales synganglionnaires pour leur indiquer quand libérer les neuropeptides dans les acini. Ceci est probablement maintenu par une impulsion électrique du neurone vers l'acinus. Cette impulsion électrique est déclenchée par des stimuli provenant de la glande salivaire vers les cellules neuronales du synganglion.
Tous ces modèles sont uniques et suggèrent une communication bidirectionnelle entre le synganglion de la tique et la glande salivaire.
L’objectif du projet AxoTick est donc d’étudier la fonction et les propriétés de ces neurones dans le contrôle neuronal des glandes salivaires chez la tique Ixodes ricinus, en utilisant des approches moléculaires, biochimiques, pharmacologiques et électrophysiologiques.
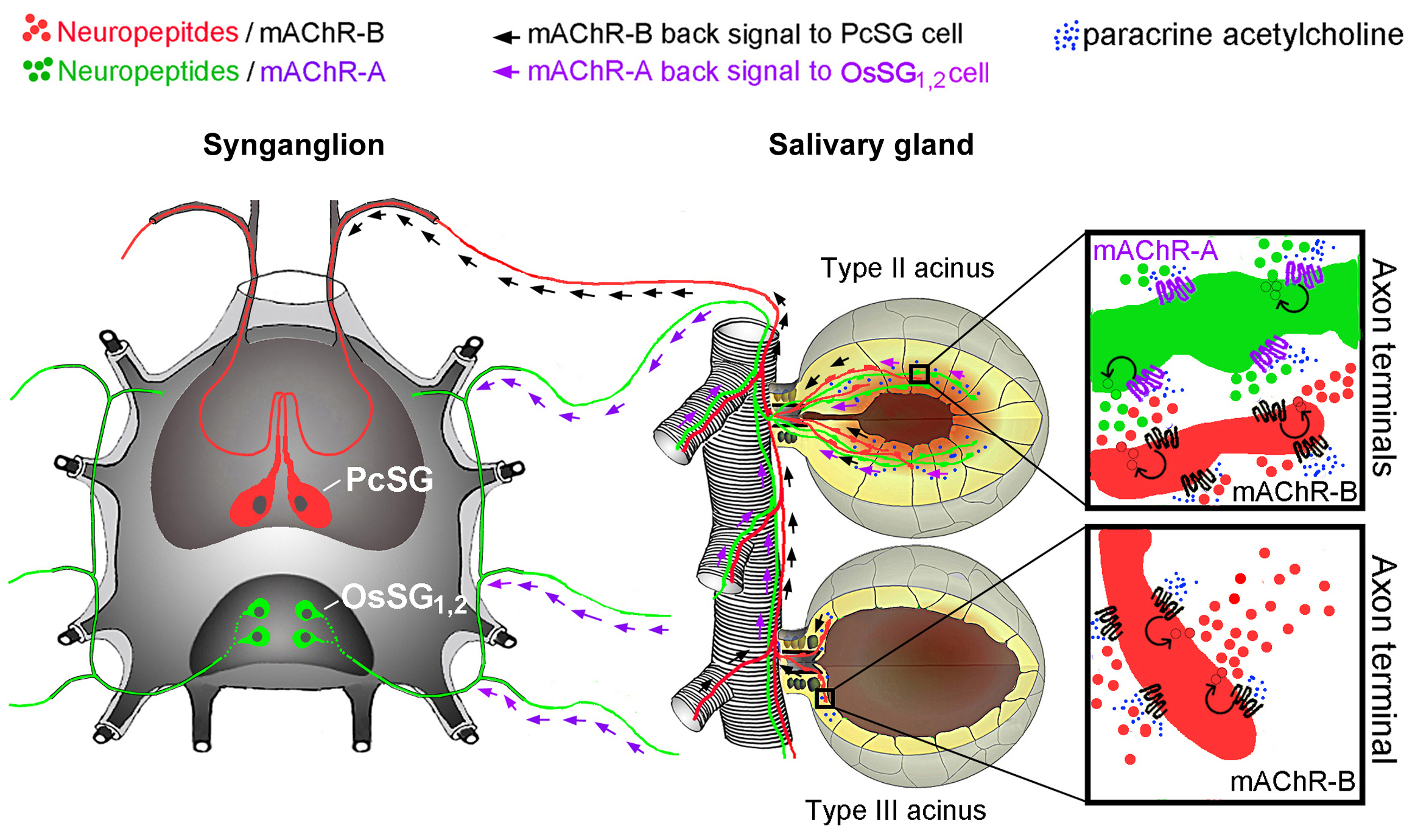
A proposed model of the acetylcholine-sensitive neuropeptidergic axons connecting the synganglion neurons and salivary gland acini type II and III. Arrows indicate the feedback signal from acini to neuronal cells. mAChR – muscarinic acetylcholine receptor.
Ce projet collaboratif implique un partenaire, le Pr Steeve Thany de l'Université d'Orléans, et durera de 2021 à 2025. Les données préliminaires qui ont été cruciales pour obtenir le financement ont été générées par la Dr. Lourdes Mateos-Hernandez (NeuroPaTick, UMR-BIPAR ANSES) et Sabine Rakotobe (NeuroPaTick, UMR-BIPAR, INRAE).
>>> À lire aussi : Et si les tiques permettaient de lutter contre un champignon affectant les cultures
>>> À lire aussi : Tiques : nouvelle découverte
>>> À lire aussi : Comprendre le repas sanguin de la tique en 3D
Description du projet - English
Project description:
The relationships between tick species and the pathogens they transmit are complex, as pathogens depend upon the tick’s saliva for their transmission into the vertebrate host. Specifically, pathogens are ingested as a part of the bloodmeal during tick feeding on their infected host, and then cross the midgut digestive epithelium and invade salivary gland, where they usually multiply and secreted saliva serves as a matrix in which pathogens are inoculated into the host. Tick saliva contains a wide variety of pharmacological compounds that are critical modulators of the host immune responses, thus enabling the tick-borne pathogens to easily enter the host system or to be acquired from infected host to ticks. In addition, the tick saliva-mediated suppression of host immune system allows ticks to stay attached on without awareness of the host for several days and successfully complete their blood feeding. Although the secretory features of tick salivary glands play a pivotal role in all these processes, there is a significant gap in the understanding of how ticks control the activities of this important organ. Consequently, disrupting salivary gland functions appears to be a highly promising target for the development of new strategies to manage ticks and subsequently tick-borne pathogens transmission.
Specific aim of the project is to investigate the cholinergic neuronal regulation of tick salivary glands activities. In our preliminary experiments we obtained an unique evidence that previously identified neuropeptidergic axons connecting the tick central nervous system, the synganglion, with different parts of the salivary glands (Fig. 1), co-express distinct types (type A and B) of muscarinic acetylcholine receptors (mAChR). Based on this unique discovery, we hypothesize that axonal mAChRs serve as upstream controls of multiple neuropeptide signals, regulating the secretory activities of salivary glands during the tick feeding. The proposed research merge the fundamental physiology of neural control of tick salivary gland with vaccination approaches to block the secretory functions of this tissue and subsequently affect tick feeding. Our hypothesis will be tested in Ixodes ricinus ticks, the principal European vector of Borrelia burgdorferi causing Lyme borreliosis and virus casing tick-borne encephalitis. Currently, not one tick research program on salivary gland molecular physiology or signal transduction systems exists, neither in France, nor in the rest of Europe. For this reason, we believe that the proposed study may greatly enrich tick research at both national and international levels.




